受注案件7327件(2025年12月末時点)の実績
「ソフテックだより」では、ソフトウェア開発に関する情報や開発現場における社員の取り組みなどを定期的にお知らせしています。
さまざまなテーマを取り上げていますので、他のソフテックだよりも、ぜひご覧下さい。
ソフテックだより(発行日順)のページへ
ソフテックだより 技術レポート(技術分野別)のページへ
ソフテックだより 現場の声(シーン別)のページへ
「ソフテックだより」では、みなさまのご意見・ご感想を募集しています。ぜひみなさまの声をお聞かせください。
私が担当している案件で、医薬関連のプログラムを担当させていただく機会があり、パソコン上のデータの取扱について色々と考えさせられました。パソコンで扱うデータはすべて「電子データ」ですが、このデータの扱いについて、医薬関連のシステムではルールが存在します。そのルールについてご紹介させていただきます。
パソコンで扱うデータは電子データですが、医薬関連のデータを扱う為にはきちんとしたルールにしたがって扱う必要があります。日本国内では厚生労働省が公開している「ER/ES指針」という内容です。米国やEUでも同様の内容が21CFR Part11、EU-GMP Annex11という内容で公開されています。
医薬関連のシステムで管理するデータは様々です。重要なデータはこれらのルールにしたがって、データを管理する必要があります。その中でもERについて、一部を取り上げてみたいと思います。
私達の身近なところでは、市販薬、病院でもらう薬などがあります。これらの医薬品は私達の病気や、怪我などの処置のために使うもので一般に「高品質で安全・安心な物」として認識されていると思います。
これらの医薬品について「安全、安心」をたもつ為に、製造にかかわる設備やデータはどのように管理され、適切な運用を行っているのでしょうか?
普段私たちも身近なところでは、パソコン上でExcelやWord、スマートフォンなどで様々な電子データを扱っています。これらの電子データは手軽に変更でき非常に便利な仕組みになっていますが、「手軽に変更できる」という点が問題になります。
また電子データの特徴として、紙に文字などで記載するアナログ記録とは異なり、データが変更されたことはひと目では分かりません。という事は医薬品などの品質にかかわる重要データが改ざんされた場合、それを知るすべがなくなってしまいます。
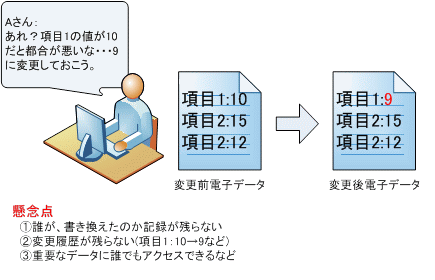
図1. 電子データの書替え時の懸念点
そこで厚生労働省の「ER/ES指針」の出番です。この指針にそって適切に運用することで、その記録が正しい事や改ざんされていない事を証明できるようになります。
ER(電磁的記録)で求められている事は色々とあるのですが、要約すると下記3点に絞り込むことができます。
この3点を満たす必要がありますが、これだけではちょっと具体性にかけるので、さらに補足すると以下の様なことを行う必要があります。
医薬関連の用語でいうと、コンピュータ化システムバリデーション(CSV:Computerized System Validation)されていることが必要です。簡単に言うと「システムで取り扱うデータやシステムそのものが正しく動作していることを検証し、その記録を残す」という事が必要です。これを行う事でシステムが取り扱っているデータの正しさや、システム全体の健全性を確保できます。
重要なシステムは誰でも操作、変更できるような状況ではセキュリティの問題があります。システムで取り扱うデータ類はユーザーが変更できないようにセキュリティ設定を行ったりするなど、適切にセキュリティを確保する必要があります。
またセキュリティを保持するために、ユーザーパスワードの有効期限の設定や、定期的な変更を行うなどの管理も必要となります。
監査証跡とはログの事です。品質にかかわる操作を行った場合、誰が、いつ、どのような操作を行ったのか記録を残す必要があります。
「誰が」という情報を記録するためには、ユーザー管理機能が必要になります。システムを操作するユーザー情報(ユーザーID、権限、パスワード、期限など)を管理し、操作時には自分のユーザーIDとパスワードでログインして操作することで、誰が、いつ、どのような操作を行ったのかシステムで記録できるようになります。
システムで取り扱うデータはバックアップが重要です。たとえばパソコンのハードディスクはいつ故障するか分かりません。そのために何のデータを、いつ、どこにバックアップするのか明確にする必要があります。もちろんバックアップしたデータは復元できる必要がありますので、その手順も明確にする必要があります。
システムで扱うデータは様々な形式でハードディスクなどの記録媒体に保存されていきます。それらのデータを参照しようとしたときに、人がそのデータを判別できるように画面出力や印刷を行える必要があります。
システムで取り扱うデータは保存期間を明確にし、その保存期間は人が判別できる形でデータを正しく参照できるようにする必要があります。
これらの要件を満たすことで、誰でも重要なデータにアクセスできなくなり、下図2のように、誰がいつ、どのデータをどのように変更したのかの記録が残るようになります。という事は安易な考えでデータ変更した場合にも記録も残ります。後から、それらの変更履歴を追う事で本来の変更前のデータ何だったのか?など調べる事も可能です。
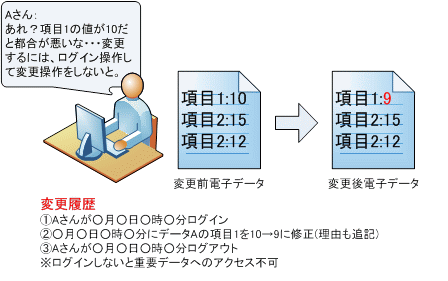
図2. ER対応後の電子データ書替えイメージ
また今回は取り上げませんでしたが、ER(電磁的記録)のほかに、ES(電子署名)という仕組みも存在します。重要な電子データは複数人の承認、審査をへて記録として管理されるのですが、「承認した」という本人サインもしくは捺印の代わりを電子的に行うのがES(電子署名)です。これらについてはまた別な機会があればご紹介したいと思いますが、このようなルールにそって運用することでデータが正しく取り扱われるように運用・管理しています。
医薬関連の仕事をさせて頂くたびに、「医薬品はこんなにも手間暇をかけて、検証を行いドキュメント整備して、その品質や安全性を確保しているのか!」と感心します。
正直それはやり過ぎ・過剰ではないか?だから医薬品は高いのか?と思う所もあります。調べてみると、医薬品にかかわる規制コストの増大が問題になっているという内容がみつかります。
この問題についてはずいぶんと前(2002年)に「リスクベースドアプローチ」という方針が発表されています。品質リスクを検証し、リスクが高いところにはコストをかける。低いところはコストを下げ全体のバランスを取るように改善しているようです。
同じソフトウェアを担当していても、医薬関連など分野が異なれば、そのソフトウェアやドキュメントで考慮しなければならない事もかなり異なってきます。
これまでも制御システムにかかわる様々な分野のソフトウェアを担当してきました。別な分野で学んだ事を医薬関連のソフトウェアに反映したり、医薬で学んだ事を他の分野のソフトウェアに反映したり出来るように知識を蓄えて、お客様に提案できるようにしていきたいと考えます。
(S.N.)
関連ページへのリンク
関連するソフテックだより
「ソフテックだより」では、みなさまのご意見・ご感想を募集しています。ぜひみなさまの声をお聞かせください。